Comme beaucoup d'autres organisations humanitaires, MSF est conscient que la qualité des médicaments et des autres produits médicaux n'est pas toujours garantie sur le marché mondial . L'équipe de coordination de l'Assurance Qualité du Bureau international (AQ BI) a mis au point trois systèmes de qualification pour la validation interne:
- des médicaments
- des dispositifs médicaux, des diagnostics in vitro et des articles de laboratoire ; et
- de l'alimentation médicale spécialisée.
Les principes:
- La qualification est une procédure d'évaluation de la qualité standardisée permettant de valider (ou non) les produits médicaux en an amont, avant qu'ils ne puissent être achetés pour être utilisés par MSF, en vérifiant que le produit répond au minimum aux normes de qualité reconnues au niveau international. Le processus de qualification consiste en l'évaluation d'un dossier produit et d'un site de fabrication (par exemple, un audit Bonnes Pratiques de Fabrication BPF).
- Les procédures de qualification de MSF sont basées sur la confiance mutuelle. Il est demandé au fabricant de certifier la véracité et l'exactitude des informations et des documents fournis à MSF. Toute erreur ou omission peut entraîner la disqualification du produit et/ou du fabricant.
- Les procédures de qualification de MSF n'ont pas pour but d'interférer avec l'initiative de préqualification des medicaments de l'Organisation Mondiale de la Santé (OMS), ni de dupliquer le travail existant effectué par les autorités réglementaires nationales strictes. Par consequent, tout médicament préqualifié par l'OMS, ou tout médicament enregistré dans un pays hautement réglementé (Stringent Regulatory Authority, SRA en Anglais) et figurant sur la liste des médicaments de MSF est automatiquement qualifié par MSF.
- MSF n'est pas une agence de régulation ni un organisme de certification. Le système de qualification de MSF a été conçu exclusivement pour MSF et les décisions prises ne sont valables que pour MSF. Les décisions sont prises en utilisant un système de notation prédéfini, afin de garantir l'impartialité.
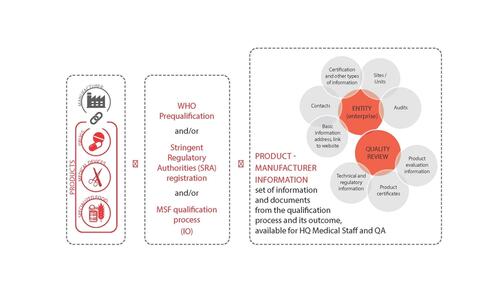
Approche:
Les produits qui ne sont ni pré-qualifié par l’OMS, ni enregistrés dans un pays á réglementation nationale stricte (Stringent Regulatory Authority, SRA en Anglais), et qui présentent un intérêt pour MSF sont évalués par l’équipe AQ de MSF. L’évaluation est faite sur la base des normes internationales de l’OMS/FAO et d’autres standards internationaux appropriés. L’évaluation suit les étapes suivantes (détails disponibless dans chaque Processus de Qualification ci-dessous):
- Évaluation basée sur le(s) questionnaire(s) du produit et/ou du fabricant
- Evaluation des Bonnes Pratiques de Fabrication (BPF): la verification de la conformité avec les standards de BPF sur le site de fabrication est la premiere étape obligatoire. Pour les médicaments, seuls les produits fabriqués conformément aux BPF de l’OMS seront ensuite évalués. Les inspections sont effectuées par des inspecteurs PQ de l'OMS ou les inspections reconnues par MSF sont prises en considération par MSF. Pour les installations qui n'ont pas été précédemment inspectées et approuvées par la PQ de l'OMS ou par des autorités de réglementation stricte (en anglais Stringent Regulatory Authorities, le coordinateur international des pharmaciens de MSF désigne un expert en BPF pour effectuer un audit. Les audits sont effectués sur la base des directives BPF de l'OMS.
- Evaluation du produit: pour les medicaments, l’évaluation est basée sur le(s) questionnaire(s) interagence(s) produit et/ou fabricant, commun(s) au groupe Pharmaceutique Interagence (UNICEF, CICR, Fond Global, centre de procurement de l’OMS, UNFPA, GDF et MSF).
- Suivi actif des dossiers
Processus de qualification MSF

Processus de qualification des médicaments de MSF

Processus de qualification des dispositifs médicaux, des diagnostics in vitro et des articles de laboratoire de MSF
Processus de qualification des aliments médicaux spécialisés de MSF
Si l'évaluation est positive, une "fiche de spécifications du produit" (PSS) résumant les caractéristiques du produit telles qu'approuvées par MSF est envoyée pour signature et sert de référence pour les achats.
La qualification MSF est une procédure continue et les produits approuvés sont contrôlés à intervalles réguliers. Les activités de surveillance se concentrent sur la réévaluation de la conformité aux BPF du site de fabrication et sur la mise à jour des informations et des données fournies pour l'évaluation du produit.
Expression d'intérêt
Les fabricants et fournisseurs de produits médicaux (médicaments, vaccins, produits alimentaires spécialisés, réactifs et équipements de laboratoire, matériel et équipements médicaux) sont invités à manifester leur intérêt pour devenir un fournisseur validé par MSF, en envoyant un courriel à l'assistant des coordinateurs AQ à l'adresse QA-Coordination-Assistant@msf.org
Les produits ne figurant pas sur la liste MSF des médicaments, la liste MSF des aliments spécialisés ou la liste MSF des dispositifs médicaux ne seront pas pris en considération.
Seuls les fabricants dont les produits ont été qualifiés par MSF seront pris en considération pour l’approvisionnement par MSF.